Nhiễm khuẩn đa kháng
Nhiễm khuẩn đa kháng là mối đe dọa to lớn bởi không thể đếm được số người đã bị nhiễm bệnh và qua đời bởi những sinh vật này trong lịch sử loài người. Do đó, điều trị hiệu quả các bệnh nhiễm trùng chính là nền tảng của chăm sóc sức khỏe hiện đại. Sự ra đời của kháng sinh chống nhiễm trùng vào giữa thế kỷ 20 là một trong những thành tựu vĩ đại về sức khỏe con người. Nó cho phép thực hiện các trị liệu cao cấp hơn như cấy ghép tạng, hóa trị ung thư hay phẫu thuật. Tuy nhiên, sự gia tăng thầm lặng của các vi khuẩn kháng kháng sinh như một đại dịch thầm lặng đang làm xói mòn sự an toàn của các trị liệu y khoa cơ bản. Tổ chức Y tế Thế giới (WHO) và Trung tâm Kiểm soát Dịch bệnh Hoa Kỳ (CDC) đã phân loại các vi khuẩn kháng kháng sinh gây ra mối đe dọa lớn nhất đối với sức khỏe con người. Trong đó, A. Baumannii là vi khuẩn đa kháng nổi lên như “ưu tiên số một”, cần nhanh chóng nghiên cứu phát triển kháng sinh mới để phòng chống [1].
A. Bumannii là thành viên thường gặp nhất trong phức hợp A. Baumannii - Calcoaceticus (ABC). Đây là các vi khuẩn gram âm cơ hội gây nhiễm trùng xâm lấn ở bệnh nhân nhập viện và bệnh nhân mắc bệnh hiểm nghèo, phổ biến nhất là viêm phổi bệnh viện và nhiễm khuẩn huyết [1].
Việc gặp phải nhiễm trùng gram âm đa kháng thuốc (MDR/multidrug-resistant) ở những bệnh nhân nặng đã trở thành một hiện tượng phổ biến tại các cơ sở chăm sóc sức khỏe. Càng ngày, các bác sỹ lâm sàng càng phải đối mặt với những mầm bệnh “không thể điều trị được”. Điều này buộc họ phải sử dụng kết hợp nhiều loại kháng sinh, trong đó có những loại mới (chưa có nhiều bằng chứng về độ hiệu quả) để giải quyết các tình huống khó khăn trong điều trị. Trong hầu hết các trường hợp, bản thân những vi khuẩn này đã có yếu tố di truyền quyết định sự kháng thuốc. Khi chúng kết hợp lại sẽ tạo ra một “cơn ác mộng với thuốc kháng sinh”. Đáng chú ý, các kiểu hình gen nguy hiểm nhất bao gồm kháng carbapenem qua trung gian biểu hiện của metallico-β-lactamase và/hoặc serine carbapenemase. Sự đề kháng oxyimino-cephalosporin có thể được biểu hiện ở vi khuẩn gram âm bởi các cephalosporinase nhiễm sắc thể cảm ứng và các β-lactamase phổ mở rộng.
Cùng với nhiều enzyme biến đổi aminoglycoside, protein liên kết với penicillin bị thay đổi, sửa đổi vị trí mục tiêu, thay đổi màng và khử porin, một số vi khuẩn có khả năng kháng lại tất cả các loại kháng sinh đã biết [2].
Nhóm Carbapenem là những kháng sinh beta lactam có phổ kháng khuẩn rộng nhất hiện nay. Các kháng sinh thuộc nhóm này có vai trò nhất định trong điều trị bao vây cũng như điều trị theo mục tiêu những trường hợp nhiễm khuẩn nặng và đa kháng, đặc biệt là những trường hợp đa đề kháng có liên quan đến trực khuẩn gram âm và các thuốc khác không hiệu quả hoặc không phù hợp. Tuy nhiên, sự biến đổi và tích lũy nhanh chóng các cơ chế đề kháng của Acinetobacter baumannii với nhiều nhóm kháng sinh đã khiến nhóm kháng sinh này trở nên lỗi thời. Ước tính tỷ lệ tử vong do nhiễm Acinetobacter baumannii kháng carbapenem (Carbapenem-resistant Acinetobacter Baumannii/CRAB) dao động từ 40 đến 60%, một phần do thiếu các lựa chọn kháng sinh điều trị hiệu quả.
Kahne - Giáo sư Hóa học và Sinh học tại Trường Y Harvard đã đặt câu hỏi về cách A. baumannii và các vi khuẩn gram âm khác tạo ra màng ngoài trong suốt 25 năm qua. Ông giải thích rằng, có một bộ máy protein được bảo tồn ở tất cả các vi khuẩn gram âm tạo nên màng này. Năm 2010, nhóm của Kahne lần đầu tiên đề xuất cơ chế về cách vi khuẩn gram âm quản lý việc vận chuyển lớp màng sinh chất lipopolysaccharid (LPS) [3]. Một trong những điểm mấu chốt khiến những vi khuẩn gram âm như A. baumannii dễ dàng chống lại các thuốc kháng sinh nằm ở LPS. Lớp màng ngoài này hoạt động như một tuyến phòng thủ, giúp vi khuẩn đề kháng kháng sinh và chất diệt khuẩn. Đó là lý do tại sao A. baumannii là mầm bệnh dai dẳng gây nhiễm khuẩn bệnh viện, bởi nó có khả năng kháng lại nhiều chất diệt khuẩn được sử dụng để vệ sinh các bề mặt được tiếp xúc thường xuyên [4].
Cơ chế độc đáo tiêu diệt vi khuẩn
Ngành công nghiệp dược phẩm đang cố gắng đáp ứng với thách thức của việc kháng kháng sinh bằng việc phát triển mạnh mẽ các kháng sinh phổ rộng mới. Sự phát triển trị liệu tích cực và mạnh mẽ nhất cho đến nay là trong lĩnh vực kết hợp β-lactam và thuốc ức chế β-lactam/β-lactamase. Một số thuốc đã được phê duyệt (ví dụ: ceftazidime/avibactam, imipenem/relebactam, meropenem/vaborbactam, ceftolozane/tazobactam và sulbactam/durlobactam) và nhiều loại đang hoặc đã hoàn thành thử nghiệm giai đoạn III (ví dụ: cefepime/taniborbactam, cefepime/zidebactam ) và sẽ sớm ra mắt để các cơ quan quản lý đánh giá. Các phương pháp điều trị đầy hứa hẹn khác cũng đang được triển khai (ví dụ cefiderocol/xeruborbactam và cefepime/enmetazobactam). Trong đó, giới y học đang kỳ vọng về tính an toàn và độ hiệu quả của Zosurabalpin khi nó được đưa vào thử nghiệm lâm sàng.
Zosurabalpin là một loại kháng sinh mới được phát triển có cấu trúc macrocyclic peptid - một cấu trúc đặc trưng có cơ chế độc đáo so với các loại kháng sinh đang được sử dụng hiện nay. Nhóm kháng sinh này được tìm thấy thông qua việc sàng lọc 45.000 macrocyclic peptid. Zosurabalpin hoạt động bằng cách ngăn chặn một cỗ máy phân tử có tên LptB2FGC vận chuyển độc tố lipopolysaccharide/LPS từ lớp màng bên trong ra bên ngoài. Những macrocyclic peptid này sẽ ức chế phức hợp protein nằm giữa màng trong và màng ngoài của vi khuẩn, dẫn đến LPS bị tích tụ bên trong tế bào đến mức gây độc và cuối cùng tiêu diệt vi khuẩn [4].
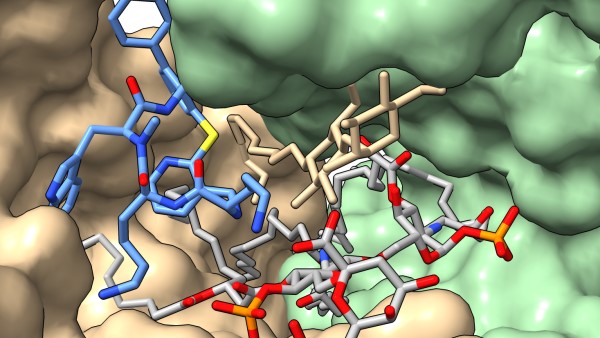
Cơ chế tác dụng của Zosurabalpin. Cấu trúc của LptB2FG trong đó Xosurabalpin (màu xanh) và LPS (màu xám) bên trong tế bào chất của vi khuẩn. Nguồn: ineosoxford.ox.ac.uk.
Các nghiên cứu trên chuột đã cho thấy kết quả đầy hứa hẹn khi Zosurabalpin loại bỏ hiệu quả nhiễm trùng CRAB ở nhiều bộ phận cơ thể khác nhau mô phỏng quá trình nhiễm trùng ở người. Thuốc hiện đang được thử nghiệm giai đoạn I trên người để đánh giá độ an toàn, khả năng dung nạp, thời gian tác dụng và bước đầu có nhiều tín hiệu đáng mừng.
Gần đây, một nghiên cứu do S. Hawser và cộng sự đã cho thấy thuốc Zosurabalpin không chỉ có hoạt tính tốt đối với các chủng vi khuẩn được phân lập từ Mỹ và châu Âu mà còn thể hiện hoạt tính kháng khuẩn in vitro mạnh mẽ chống lại các chủng phân lập lâm sàng của Acinetobacter lưu hành ở Trung Quốc [5]. Trong khi cộng đồng khoa học hoan nghênh sự tiến bộ này thì vẫn còn nhiều sự thận trọng. Đầu tiên, các nhà nghiên cứu đã ghi nhận một số đột biến gen làm giảm hiệu quả của thuốc trong điều kiện phòng thí nghiệm. Thứ hai, cơ chế lây nhiễm LptB2FGC độc đáo này chỉ gặp trên CRAB, do đó Zosurabalpin sẽ chỉ tiêu diệt được CRAB chứ không tiêu diệt các bệnh do các loại vi khuẩn khác gây ra. Điều này có nghĩa là các bác sỹ sẽ cần chẩn đoán chính xác bệnh nhân bị nhiễm trùng để quyết định xem Zosurabalpin có phải là loại thuốc phù hợp hay không [6].
Theo GlobalData - một công ty phân tích và dữ liệu hàng đầu thế giới, ngoài Zosurabalpin, còn có 9 loại thuốc khác hiện đang được phát triển lâm sàng để điều trị nhiễm trùng Acinetobacter [7]. Điển hình là Fetroja, đã được bán trên thị trường để điều trị nhiễm trùng đường tiết niệu và viêm phổi bệnh viện, hiện đang được phát triển ở giai đoạn cuối tại Mỹ, châu Âu và Nhật Bản. Do đó, các thử nghiệm lâm sàng cần được tiến hành bổ sung nhằm đánh giá thêm về độ an toàn và hiệu quả của thuốc trước khi đưa lên cơ quan quản lý dược phẩm xem xét và phê duyệt. Ngay cả khi đáp ứng tốt trong các thử nghiệm lâm sàng, Zosurabalpin vẫn cần phải thông qua các quy trình phê duyệt thông thường trước khi có thể được cung cấp tới bệnh nhân.
TÀI LIỆU THAM KHẢO
[1] C. Zampaloni, P. Mattei, K. Bleicher, et al. (2024), “A novel antibiotic class targeting the lipopolysaccharide transporter”, Nature, 625, pp.566-571.
[2] R.A. Bonomo, F. Perez, A.M. Hujer, et al (2024), “The real crisis in Antimicrobial resistance: Failure to anticipate and respond”, Clinical Infectious Diseases, ciad758, DOI: 10.1093/cid/ciad758.
[3] S.S. Chng, L.S. Gronenberg, D. Kahne (2010), “Proteins required for lipopolysaccharide assembly in escherichia coli form a transenvelope comple”, Biochemistry, 49(22), pp.4565-4567, DOI: 10.1021/bi100493e.
[4] J. Robinson (2024), “Explainer: A new antibiotic class has been discovered - how excited should we get?”, https://www.chemistryworld.com/news/explainer-a-new-antibiotic-class-has-been-discovered-how-excited-should-we-get/4018765.article?fbclid=IwAR0mAex8ddZ9037HkWlDEm-0Wdrh__MRczU5iGq4F1f_2lfcnEIOoJmnfag&adredir=1, accesed 16 January 2024.
[5] S. Hawser, N. Kothari, T. Valmont, et al. (2023), “Activity of the novel Antibiotic Zosurabalpin (RG6006) against clinical Acinetobacter isolates from China”, Open Forum Infect Dis., 27(10), DOI: 10.1093/ofid/ofad500.1754.
[6] A. Widodo (2024), “New antibiotic Zosurabalpin shows promise against deadly superbugs”, https://dentalresourceasia.com/vi/new-antibiotic-zosurabalpin-shows-promise-against-deadly-superbug, accesed 10 January 2024.
[7] GlobalData (2024), Zosurabalpin Shows Promise in The Fight Against Antibacterial Resistance, https://www.clinicaltrialsarena.com/analyst-comment/zosurabalpin-promise-antibacterial-resistance/?cf-view&cf-closed, accesed 16 January 2024.